Bylo zjištěno, že za jejich terapeutickým efektem stojí především tvorba bioaktivních látek (cytokiny, chemokiny, růstové faktory atd.). Byl prokázán příznivý vliv MSC na imunitně zprostředkovaná onemocnění u lidí i zvířat (např. imunitní artritidy, nespecifické střevní záněty a Crohnova nemoc, astma, atopická dermatitida atd.), využívají se též u transplantací. Bioaktivní látky produkované MSC mají účinek imunomodulační, regenerativní, trofický, angiogenetický, antiapoptotický apod. V poslední době se ukazuje, že MSC mají též antimikrobiální efekt. V souvislosti s narůstajícím problémem antimikrobiální rezistence je toto zjištění velmi významné.

Antimikrobiální rezistence je schopnost mikroorganismu (např. bakterie, viru nebo parazita) odolávat účinku antimikrobiální látky (např. antibiotik při léčbě bakteriálních infekcí). Rezistence je způsobena především nevhodnou indikací nebo nesprávným dávkováním nebo délkou léčby antimikrobiální látkou. I laické veřejnosti je známa existence „superkmenů“, které jsou prakticky nezničitelné. Protože antimikrobiální rezistence ohrožuje populaci (nejen lidskou, ale i zvířecí), je snaha tento celosvětový problém řešit. Kromě zodpovědného používání antimikrobiálních látek se hledají i jiné cesty, jak zvládnout tuto nebezpečnou situaci – jedním z nově zkoumaných způsobů léčby infekcí je i využití kmenových buněk.
Antimikrobiální efekt kmenových buněk může být přímý nebo nepřímý. Přímý efekt spočívá v tvorbě látek nazývaných antimikrobiální peptidy (AMP), které interagují přímo s mikrobem a vedou k jeho eliminaci. Mezi nejznámější patří cathelicidiny, defensiny, lipokaliny, hepcidin.
Je popsáno cca 1 200 různých AMP, jež produkují živočišné druhy, od prokaryot až po člověka. Jsou produkovány různými buňkami, byla popsána jejich tvorba i v MSC. Chemicky se jedná o aminokyseliny s krátkým řetězcem a tvoří důležitou součást vrozené imunity, mohou přímo způsobovat smrt mikrobů nebo modulovat vrozenou imunitní reakci. Mohou být produkovány kontinuálně nebo jako odpověď na zánět/infekci. Zdá se, že jejich tvorba je druhově specifická a odlišná i dle původu MSC. Rozdílné je i spektrum patogenů, proti kterým působí, ale obecně se mohou uplatňovat nejen v obraně proti bakteriím, ale i virům, prvokům a houbám. U lidských MSC byla prokázána účinnost proti gram pozitivním i gram negativním bakteriím.
Cathelicidiny jsou jednou z hlavních skupin AMP. K nim se řadí např. peptid LL37, který narušuje bakteriální membrány, což vede k lýze a smrti bakterie. Jsou schopny též indukovat chemokiny a cytokiny (faktor stimulující kolonie makrofágů (MCSF), IL1-ß aj.). Ve studiích byla zjištěna účinnost cathelicidinů konkrétně např. proti Escherichia coli, Pseudomonas aeruginosa, Staphylococcus spp., Candida albicans. V některých případech vykazovaly MSC dokonce lepší efekt než konvenčně užívaná antibiotika.
Další skupinou jsou defensiny, což jsou kationické proteiny, jež depolarizací narušují bakteriální membránu (má záporný náboj), vytváří v ní póry nebo se v membráně ukládají, což vede k narušení její funkce. Lipokaliny (nejznámější je lipokalin 2) jsou schopny vázat železo, které je důležité pro růst bakterií a nedostatek tedy brzdí jejich růst. Homeostázu železa ovlivňuje též hepcidin, což je další zástupce AMP.
Indolamin-2,3-dioxygenáza (IDO) snižuje lokální množství tryptofanu, čímž dochází ke zpomalení růstu bakterií. Produkce IDO byla prokázána u MSC lidí, u myších MSC produkce prokázána nebyla, u koní pak střídavě.
Možným mechanismem antimikrobiálního účinku MSC je i jejich schopnost fagocytózy (např. prokázána u Mycobacterium tuberculosis) nebo narušování biofilmu produkovaného bakteriemi. Udává se, že k průniku antibiotik přes biofilm je potřeba jejich 100–1000x větší dávka. Účinnost MSC narušovat biofilm byla pozorována např. u Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis.
Mezenchymální kmenové buňky
Nepřímý antimikrobiální efekt MSC je zprostředkován parakrinní sekrecí nebo přímým buněčným kontaktem mezi MSC a efektorovou buňkou. MSC jsou takto schopny ovlivňovat chování buněk imunitního systému, např. aktivují buňky, zlepšují fagocytózu neutrofilů a makrofágů, snižují apoptózu monocytů, indukují protizánětlivý M2 fenotyp makrofágů, navyšují neutrofilní extracelulární pasti bránící šíření bakterií apod.
Na druhou stranu jsou bakterie a jiné patogeny schopny negativně ovlivňovat MSC. Mohou způsobit snížení viability MSC, změny proliferační aktivity a diferenciační kapacity, navození apoptózy MSC, je popsána i alterace imunosupresivní funkce MSC. Chlamydia trachomatis je schopna v MSC vyvolat snížení tvorby látek, jež se uplatňují při eliminaci chlamydií z buněk. P. aeruginosa nejdříve v MSC navýší syntézu cytokinů, ale nakonec vyvolá apoptózu buněk.
Ačkoliv in vivo klinické studie zkoumající použití MSC u infekcí koní nejsou v literatuře zmiňovány, existují in vitro studie zkoumající účinek koňských MSC na různé patogeny. V jedné studii byl zkoumán účinek MSC z periferní krve koní nebo účinek média, ve kterém byly tyto buňky kultivovány (tzv. conditioned medium, CM-MSC), na časté patogeny kožních infekcí – E.coli a S.aureus. Je známo, že MSC svými signály reziduálním kožním buňkám podporují hojení, ale antibakteriální aktivita přímo zkoumána nebyla. Bylo zjištěno, že MSC i CM-MSC inhibují růst obou druhů bakterií. Byla prokázána tvorba čtyř AMP – cystatinu C, lipokalinu 2, cathelicidinu a elafinu. Nebyla prokázána syntéza ß-defenzinu 2. Autoři také zjistili, že se v antimikrobiálním účinku uplatňují i jiné mechanismy – po vyblokování činnosti AMP specifickými protilátkami byla i nadále zachována určitá antimikrobní aktivita MSC.
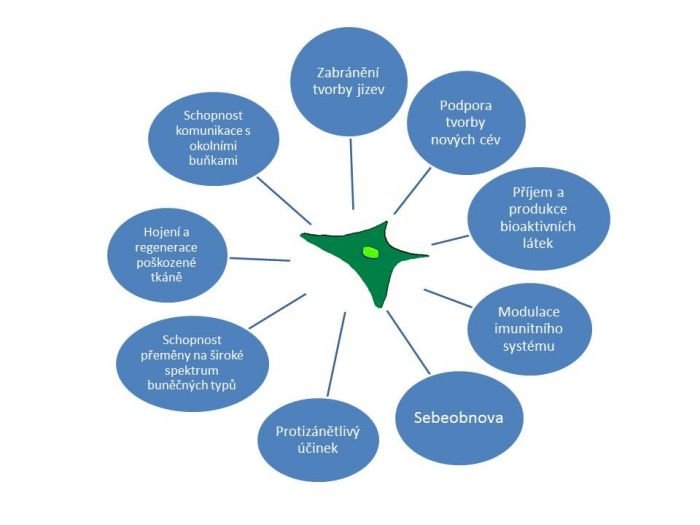
Vlastnosti kmenových buněk
Jiná studie porovnávala tvorbu různých AMP v závislosti na zdroji MSC (endometrium, kostní dřeň, tuk). Bylo prokázáno, že všechny tři typy MSC pocházejících z těchto tkání tkání mají přímé a nepřímé antimikrobiální vlastnosti. CM-MSC ze všech zdrojů MSC oslabovalo růst E.coli, všechny typy MSC tvořily lipokalin 2, exprimovaly imunomodulační geny (pro MCP-1, IL-6, IL-8, CCL-5) a tvořily cytokiny stimulující imunitní buňky (např. IL-6, IL-8, MCP-1, chemokinový ligand 5, TLR-4). Byly nalezeny i rozdíly, největší inhibiční vliv a největší produkci lipokalinu 2 měly endometriální MSC. Exprese imunomodulačních genů byla nejméně vyjádřena v tukových MSC. Studie zmiňuje, že největší efekt AMP je nejspíše způsoben přes ovlivnění imunitních buněk tvorbou cytokinů a chemokinů (např. IL-6, IL-8), což vede k aktivaci neutrofilů a dalších buněk.
Další studie zkoumá možnost ovlivnit biofilm methicilin-rezistentního zlatého stafylokoka (MRSA). Bylo zjištěno, že MSC z periferní krve koní účinně inhibují růst různých bakterií spojených s chronickými infekcemi, jako jsou nehojící se kožní rány, prostřednictvím sekrece AMP. Cílem této studie bylo vyhodnotit in vitro účinnost látek sekretovaných MSC proti různým patogenům vytvářejícím biofilm včetně MRSA a prozkoumat mechanismy, které ovlivňují bakteriální biofilmy. Za tímto účelem byly použity koňské MSC, protože kůň představuje fyziologicky relevantní model pro hojení lidských ran a nabízí se jako model pro MSC terapii u lidí. Bylo zjištěno, že sekretom MSC inhibuje tvorbu a maturaci biofilmů různých bakterií, jako např. P. aeruginosa, S. aureus a S. epidermidis. Dále bylo prokázáno, že koňské MSC vylučují cysteinové proteázy, které destabilizují biofilmy MRSA, čímž zvyšují účinnost antibiotik, která byla dříve biofilmy tolerována. V tomto experimentu bylo tvorbu biofilmu MRSA schopno inhibovat pouze médium CM-MSC, nikoli antibiotická terapie. Sekretom MSC se tedy nabízí jako doplňková léčba bakteriálních kožních infekcí u lidí i koní.
Proběhla zajímavá in vivo studie na osmi psech zaměřená na léčbu chronických kožních infekcí způsobených multirezistentními kmeny bakterií. K nasazené antibiotické terapii byla přidána aplikace MSC z tukové tkáně (celkově tři intravenózní aplikace). Pět psů se kompletně zbavilo patogenního mikrooganismu, dva další částečně.
Ukazuje se, že roli hraje i načasování terapie. V jedné studii bylo dále zjištěno, že nízká koncentrace Porphyromonas gingivalis navyšuje protizánětlivý a antibakteriální efekt MSC, naopak vysoké koncentrace bakterie efekt MSC inhibuje. Při použití MSC v případě toxického šokového syndromu, jež je doprovázen tzv. cytokinovou bouří, není počáteční snížení množství prozánětlivých cytokinů doprovázeno prodloužením přežití pokusných zvířat. Vypadá to, že vysoké množství bakterií inhibuje antibakteriální odpověď MSC.
Závěrem lze shrnout, že výzkum stojí teprve na začátku, k pochopení problematiky je potřeba dalších studií. Lze však předpokládat, že kmenové buňky sice nejspíše antibiotika kompletně nenahradí, ale mohou nám pomoci snížit jejich spotřebu.
Zdroje:
MVDr. Markéta Slaná je členkou týmu projektu Avecell. AVECELL® je veterinární projekt Medicínského centra Praha, v němž se tým odborníků zaměřuje na výzkum a využití nových metod léčby pomocí aplikace kmenových buněk ve veterinární medicíně.
 Medicínské centrum Praha získalo povolení pro výrobu veterinárního léčivého přípravku (autologní mezenchymální kmenové buňky) od Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv (ÚSKVBL) v květnu 2015.
Medicínské centrum Praha získalo povolení pro výrobu veterinárního léčivého přípravku (autologní mezenchymální kmenové buňky) od Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv (ÚSKVBL) v květnu 2015.

Ostrov Naděje v Běstvinách u Dobrušky se ponoří do sváteční atmosféry. Už tuto sobotu 13. prosince od 1...

Pět, čtyři, tři… a kruciš! Jistě víte, že si parkuroví jezdci odpočítávají cvalové skoky před odskok...