 Většina z nás si pamatuje ze školy, že mitochondrie fungují v buňce jako malé elektrárny. Jejich funkce a původ je však mnohem zajímavější. Výzkumy přináší stále nové poznatky a za výzkum mitochondrií už bylo uděleno několik Nobelových cen. Jejich příběh začal přibližně před 2 a půl miliardami let… a dosud se podílí na tom, čím jsme dnes.
Většina z nás si pamatuje ze školy, že mitochondrie fungují v buňce jako malé elektrárny. Jejich funkce a původ je však mnohem zajímavější. Výzkumy přináší stále nové poznatky a za výzkum mitochondrií už bylo uděleno několik Nobelových cen. Jejich příběh začal přibližně před 2 a půl miliardami let… a dosud se podílí na tom, čím jsme dnes.
Endosymbióza – unikátní fúze
Země se zrodila asi před 4,5 miliardami let a první dvě miliardy let zde žily jen jednobuněčné, prokaryontní organismy (bakterie), viry. Nebyl tu žádný kyslík, nebo ho bylo velmi málo. Prapůvodní bakterie – archeobakterie získávaly energii fermentací, množily se dělením. Když pak začal stoupat obsah kyslíku (fotosyntéza), což je v podstatě velmi toxický prvek, objevily se bakterie, které pro něj měly vytvořené určité metabolické dráhy (spíše jim šlo původně o to, jak se kyslíku zbavit). A pak se stalo něco, co zcela přehodilo výhybku vývoje život směrem k vícebuněčným organismům. Dosud samostatně vegetující bakterie, řekněme pramitochondrie, která dokázala pracovat s kyslíkem, se spojila s nějakou archeobakterií. Archeobakterie dodávala živiny, které pramitochondrie zpracovávala oxidací a dodávala hostitelské buňce energii. Jinými slovy nastala endosymbióza – kdy jeden organismus pohltil jiný. K této endosymbióze podle vědců došlo jen jedinkrát v celé historii – tzn. že všechny mitochondrie v naší biosféře mají bakteriální původ a pocházejí z tohoto jednoho, jediného prazákladu.
K čemu je potřebujeme – my i koně
Koně patří mezi elitu mezi aerobními savčími atlety, a stejně tak člověk. S každým nádechem dodáváme buňkám kyslík do těchto malých elektráren, které s jeho pomocí efektivně produkují energetické oběživo – makroergní molekuly ATP, kterými platíme za fungování svalů, našeho těla a mysli. Hodně zdravých mitochondrií znamená hodně energie. Kdo by je nechtěl? Než se vydáme na exkurzi do neuvěřitelně důmyslného buněčného dýchání, podíváme se do samotné strojovny.
V nitru zázračné organely
Mitochondrie je organela, což označuje jakýsi mikroskopický vnitřní orgán buňky. Najdeme je ve všech buňkách kromě červených krvinek (v dospělých červených krvinkách nejsou, protože by spotřebovávaly část kyslíku na výrobu energie, což by nebylo moc efektivní – jejich hlavním úkolem je naložit kyslík, dopravit ho až těmi nejtenčími kapilárami k buňkám a odvézt kysličník uhličitý. Červené krvinky pro získání energie vystačí s glukózou a anaerobním režimem).
Mitochondrie mají dvě membrány, vlastní DNA (genom obsahuje jen 37 genů) a 13 využívá na výrobu vlastních proteinů, které jsou zásadní součástí dýchacího řetězce (těch 13 proteinů samozřejmě na všechny procesy nestačí – většinu ostatních kóduje DNA jádra buňky). Dědí se jen po mateřské linii. Spermie sice obsahují mitochondrie, které zajistí energii pro jejich pohyb, ale po oplození jsou zničeny – neboli „ubikvitinizovány“.
Víme, že membrány nejsou jen pouhé obaly, které nějaký obsah uzavřou. Jsou velmi vybíravé v tom, co pustí dovnitř a ven. K tomu mají spoustu různých pump a kanálů a transportérů.
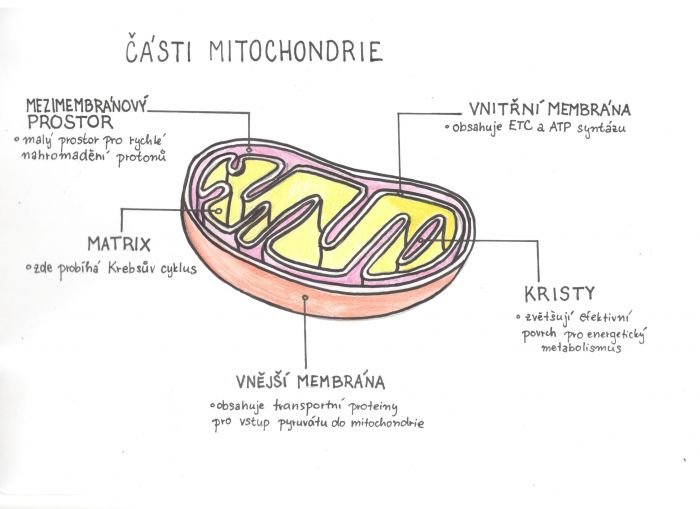
Vnější membrána mitochondrie je propustná pro většinu látek, zatímco vnitřní membrána je extrémně neprostupná a pustí dovnitř a ven jen omezený počet látek skrz specifická „zařízení“ – jinak by nemohl fungovat důmyslný dýchací řetězec, syntéza ATP v aerobních podmínkách a další importní zařízení.
Vnitřní membrána je skládaná a samotné záhyby se nazývají kristy. Důvodem skládaného tvaru je získat co největší povrch pro výrobu energie a není divu, že nejvíce krist najdeme v mitochondriích buněk srdečního svalu. V prostoru mezi kristami je hutný, gelový matrix (asi 50 % vody) – nezabírá moc místa, ale najdeme v něm např. proteiny, enzymy, kofaktory. Ta hutnost je celkem nutná, protože pokud nejsou určité molekuly hodně blízko u sebe, k některým reakcím by těžko vůbec docházelo.
Mitochondrie také nejsou striktně samostatné elipsoidní útvary – spojují se i rozpojují, mění tvar, dělí se. Tvoří vlastně takovou síť – mitochondrion.
V matrixu mitochondrie probíhá Krebsův (citrátový) cyklus, kde se sbíhají metabolické dráhy odbourávání sacharidů, tuků a bílkovin – vznikají tzv. redukované koenzymy a ty vstupují do elektronového transportního systému, který běží právě v kristách vnitřní membrány. Krebsův cyklus, elektronový transportní systém a syntéza ATP dohromady tvoří dýchací řetězec neboli oxidativní fosforylaci.
Pohon buněk
Pro zopakování ze střední školy – buňka potřebuje energii, kterou získává ze třech systémů. Nositelem energie, jakýmisi „energetickým oběživem“, je ATP – adenosintrifosfát. Mitochondrie není jediným producentem ATP v buňce, zato nejefektivnějším.
Elektronový transportní systém – hon na kyslík
Zpočátku to zní složitě, ale uvidíte, že je to dobře vymyšlené. Elektrárnu na výrobu energie, která se nachází na vnitřní membráně, tvoří 4 velké proteinové komplexy a ATP syntáza. Tyto komplexy si předávají elektrony (proto se tomu také říká elektronový transportní systém – ETC).
V matrixu mitochondrie plave koenzym NADH (má elektrony). Jeho elektrony potřebujeme dostat ke kyslíku, ale na to potřebuje prostředníky. Nejprve předá NADH dva elektrony prvnímu nanostroji – je to proteinový Komplex I. Dále elektrony mezi komplexy I a III putují přenašečem, což je koenzym Q10. Z komplexu III do IV přenáší elektrony cytochrom c. Ten si počká, než má dohromady 4 elektrony, a konečně je přenese na kyslík a vzniká voda.
Chybí ve výčtu komplex II – do něj vstupují elektrony z Krebsova cyklu a ty opět přebírá přenašeč koenzym Q10 a ten je předává na komplex III. Dalším zdrojem elektronů pro přenašeč Q10 je např. ETF – další flavoprotein přebírající elektrony z oxidace mastných kyselin.
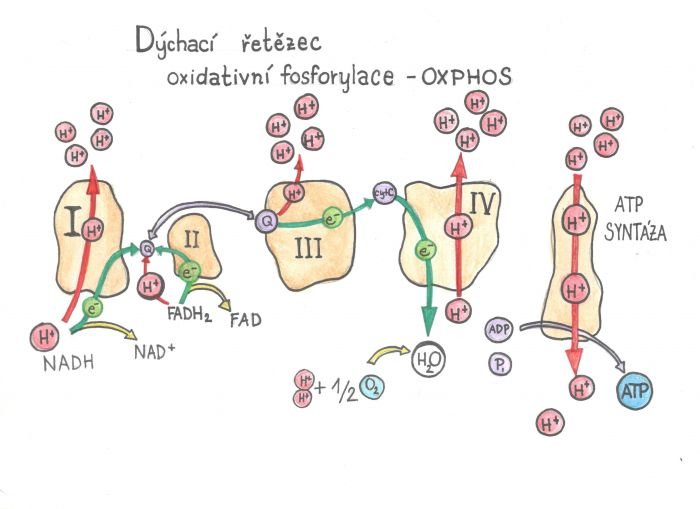
 Při předávání elektronů se generuje energie, která je využita na pumpování protonů z každého komplexu do mezimembránového prostoru – kde jich je pak víc než v matrix a vzniká tak koncentrační gradient a rozdíl v pH. Protony se chtějí dostat do matrixu, kde jich je méně, aby se koncentrace vyrovnaly. To se jim podaří jen přes vnitřní membránu a ta je zpátky pouští přes další komplex – ATP syntázu (obr. vlevo), která funguje opravdu jako turbína. Jak do ní protony „skáčou“, roztáčí jednu část ATP syntázy – stejně jako voda v elektrárně roztáčí turbínu. A protože tento stator je asymetrický, tak při otáčení naráží do stěn, dochází k reakci a změně ADP na ATP. Britský vědec Dr. Peter Mitchel získal za objev mechanismu ATP syntázy Nobelovu cenu v roce 1978.
Při předávání elektronů se generuje energie, která je využita na pumpování protonů z každého komplexu do mezimembránového prostoru – kde jich je pak víc než v matrix a vzniká tak koncentrační gradient a rozdíl v pH. Protony se chtějí dostat do matrixu, kde jich je méně, aby se koncentrace vyrovnaly. To se jim podaří jen přes vnitřní membránu a ta je zpátky pouští přes další komplex – ATP syntázu (obr. vlevo), která funguje opravdu jako turbína. Jak do ní protony „skáčou“, roztáčí jednu část ATP syntázy – stejně jako voda v elektrárně roztáčí turbínu. A protože tento stator je asymetrický, tak při otáčení naráží do stěn, dochází k reakci a změně ADP na ATP. Britský vědec Dr. Peter Mitchel získal za objev mechanismu ATP syntázy Nobelovu cenu v roce 1978.
Ale proč si tyhle „mašinky“ předávají elektrony tak komplikovaně? Proč nepředají molekuly NADH elektrony kyslíku rovnou? Je to z toho důvodu, že by bylo příliš mnoho energie najednou ve formě světla, tepla a nebylo by pro buňku snadné ji nějak zpracovat. Kyslík je celkem specifický, co se týče elektronové výbavy. Je nejdychtivějším příjemcem elektronů (po fluoru). Samotná reakce vodíku a kyslíku je natolik prudká, že se používá u raketových motorů.
Mmch. pro představu, jak je velký elektrický potenciál mezi matrix a mezimembránovým prostorem – 150–180 mV. Když vezmeme tloušťku membrány 6 nanometrů a převedeme ji na 1 m, pak se jedná o 30 milionů voltů.
Výše uvedené – dýchací řetězec, se dnes nazývá oxidativní fosforylace. Je to velmi efektivní cesta získání ATP. Anaerobní glykolýzou jedné molekuly glukózy, která neprobíhá v mitochondrii, ale v cytosolu buňky, se získají 2 ATP, zatímco oxidativní fosforylací 38, využitelných je 30–32. Je to tedy 16x výkonnější systém. Dýchací řetězec sice nabíhá pomalu, ale může energii generovat prakticky nekonečně. To oceňují především vytrvalostní jezdci a maratonci.
Odpřahovací proteiny
Ovšem nejen ATP syntáza umí propouštět protony do matrix. Existují tzv. odpřahovací proteiny (uncoupling protein – UCP), které umí zvýšit propustnost membrány, kudy protony protečou a prakticky obejdou ATP syntázu. Vzniká tak energie, která není využita na tvorbu ATP, ale na teplo – organismus se tak zahřívá bez svalového třesu neboli ne-třesovou termogenezí. Odpřahovací proteiny se nejvíce nacházejí v tzv. hnědém tuku. Najdeme ho u lidských novorozenců, hibernujících zvířat, malých savců. Zajímavé je, že koně, sloni nebo velryby UCP1 postrádají – nemají ne-třesovou termogenezi. Ani u hříbat vědci hnědý tuk obsahující UCP1 nenašli, ale hříbě je na rozdíl od lidského novorozence schopné se zahřát prací svalů – třesením (třesová termogeneze) už několik minut po narození – samozřejmě tím ztrácí spoustu energie. (Plod se dokáže zahřát netřesovou termoregulací, tento proces je však v děloze inhibován a po narození se zahřívá svalovým třesem, pokud je to nutné). Samozřejmě, že vědce už dávno napadlo využít odpřahovací protein na léčbu obezity – živiny se budou spalovat, ale nevznikne energie, která se uloží ve formě tuku, ale jen teplo. Např. dnes zakázaný 2,4dinitrofenol (DNP) funguje stejně, ale bohužel je jeho užívání velmi riskantní, umíralo se na něj. Nepodařilo se najít rovnováhu mezi spotřebou živin a dostatku ATP pro práci srdce. Ovšem dokázal zrychlit metabolismus až o 50 %, ale také zvednout teplotu nad 40 °C. Dosud se dá sehnat na internetu.
V každé buňce najdeme stovky až tisíce mitochondrií a v každé mitochondrii je zase několik set až tisíc takových nanostrojů. Pro představu – 70 % ATP u lidí využívá mozek, proto dysfunkce mitochondrií má silnou korelaci s neurodegenerativními změnami. Zdravý člověk denně produkuje tolik kg ATP, kolik sám váží.
Pokud výše uvedené shrneme, chápeme, odkud se vzal bakteriální původ mitochondrie, a velmi stručně jsme nastínili práci dýchacího řetězce (jinak oxidativní fosforylace), je nám jasné, jak je tento živý stroj důmyslný a stojí za to, abychom se o něj starali a zbytečně ho nepoškozovali – a to nejen ten koňský, ale i ten náš.
Mitochondrie a trénink
Mitochondriím prospívá pohyb. ATP má odbyt, transport elektronů běží, mitochondrie se dělí.
Studie u lidí a rodentů ukazují, že adaptivní zátěž zlepšuje produkci energie a současně minimalizuje vznik volných radikálů (často vznikají u obézních nebo neaktivních jedinců v ETC, kdy dochází k úniku elektronů). Jen odbočka – volný radikál je molekula, která ztratila elektron, nemá je tedy spárované a není stabilní – má tedy velký zájem reagovat se vším možným – sebere elektron jiné látce a tím může vyrobit další volný radikál a ničit tak další buňky… Právě v elektronovém transportním řetězci dochází ke vzniku volných radikálů, což se v menší míře děje běžně a organismus je dokáže využít. Nadměrné množství volných radikálů má však devastující účinky.
Submaximální trénink u mladých koní zlepšuje funkci mitochondrií u gluteus medius (střední hýžďový sval), ale nikoliv v triceps brachii (trojhlavý pažní sval). Předpokládalo se, že vyšší obsah svalových vláken typu I (pomalá vlákna s vyšším obsahem mitochondrií) v triceps brachii odpoví na zátěž významněji, ale vyšší biogeneze mitochondrií se objevila v gluteus medius. Vědci spekulovali, že hýžďový sval má za úkol generovat pohyb vpřed zadníma nohama, zatímco triceps má spíše posturální funkci, nemusí tedy být pro něj zátěž dostatečnou stimulací pro zvýšení biogeneze.
Neznamená to ovšem, že více mitochondrií představuje zvýšenou oxidativní kapacitu ve svalech. U neaktivních koní byla kapacita komplexů I a II nižší než u koní sportovních. U vytrvalostních koní byla kapacita oxidativní fosforylace (OXPHOS) na komplexu I významně vyšší po 10 týdnech vytrvalostního tréninku, zatímco u komplexu II se zvýšila až po dalších 10 týdnech. Z toho vyplývá, že kůň se na zátěž adaptuje na úrovni mitochondriální funkce. Rozdíly v dopadu fyzické zátěže se prokázaly mezi dospělými a mladými, ještě rostoucími koňmi. Rozdíly jsou také mezi plemeny. Podle vědců má na mitochondriální funkce největší vliv růst, během něhož se postupně zvyšuje mitochondriální kapacita pro výrobu energie.
Trénink zlepšuje oxidativní kapacitu svaloviny. Nejmenší úroveň oxidativní fosforylace byla zjištěna u obézních a netrénovaných koní, zatímco sportovní koně měli nejvyšší respirační parametry.
Spojenectví mitochondrie a střevní fauny
Určité typy střevních bakterií produkují chemické signály – malé molekuly, metabolity komunikující s mitochondriemi. (Eric Barey, Státní výzkumný ústav pro zemědělství, potraviny a životní prostředí, Francie).
Určité bakterie „zapínají geny“, které řídí aktivity související s adaptací energetického metabolismu v mitochondrii. Bakterie produkující butyrát a mitochondriální proteiny vykazují pozitivní korelaci, což vypovídá o tom, že butyrát vysílá signál k aktivaci mitochondriálních genů. Mezi bakterie produkující butyrát patří lachnosiraceae (Oribacterium, Butyrivibrio, Agathobacter a Eubacterium), ruminococcaceae, Spirochaetaceae (Treponema). Suplementace butyrátem u lidí zlepšuje oxidativní svalový fenotyp, počet mitochondrií a počet svalových vláken I. Obchodníci jsou pohotoví – a přípravky s butyrátem pro lidi najdete na internetu v mnoha obměnách.
Mitochondrie a stres
Stres má souvislost s mitochondriemi ve čtyřech oblastech:
Stav mitochondrií se odráží na psychice a obráceně.
Mitochondrie a laminitida
U koní s akutní laminitidou je výrazně snížená oxidativní fosforylace ve svalech v porovnání s hodnotami zdravých koní. Anaerobní glykolýza nedokáže dostatečně kompenzovat nízkou produkci ATP dýchacím řetězcem. Jedná se o široké téma související s EMS, inzulinovou rezistencí a obezitou, nicméně oxidativní stres a poškození mitochondrií v tom hraje významnou roli. I když přímo v kopytě nedochází k mitochondriální dysfunkci, nedostatek energie zřejmě způsobuje poškození hemidesmosomů (buněčných spojení), což vede k selhání dermo-epidermálního rozhraní. Řasa Spirulina platensis se ukázala jako vhodný doplněk pro podporu mitochondrií.
Co se týče atypické myopatie způsobené hypoglycinem, který obsahují semena javoru (Acer pseudoplatanus), dochází k závažné změně energetického metabolismu. Poškození energetického metabolismu mitochondrií (oxidace mastných kyselin) je příčinou častých úmrtí.
Jak zabít mitochondrie
Pokud řetězec přerušíme, přestane buňka vyrábět ATP. Např. kyanid zničí přenašeč cytochrom c, řetězec se přeruší na úrovni komplexu III a jedinec velmi rychle umírá.
Jak poškodit mitochondrie
Jak u lidí, tak u koní – nedostatkem pohybu, stresem, antibiotiky, přejídáním. Antibiotika poškozují mitochondriální DNA, zvyšují produkci volných radikálů a narušují syntézu ATP. Proto jsme tak malátní a bez síly během braní antibiotik. Antibiotika ničí bakterie a vzhledem k bakteriální podstatě mitochondrie jejich podávání má tyto vedlejší účinky. (U lidí alkohol plení koenzym NADH potřebný pro produkci ATP.)
Mitochondrie a buněčná smrt
Mitochondrie také komunikují s buněčným jádrem a dávají signál apoptóze – což je řízená buněčná smrt. Tento mechanismus umí každá buňka. Když obdrží mitochondrie signály, že je něco hodně špatně, dá pokyn ke zničení buňky. K tomu jsou potřeba zdravé mitochondrie – aby signál vůbec mohly poslat. Pokud mají metabolismus narušený, nemohou signál k buněčné smrti vyslat – vznikají tzv. zombie buňky. Nedokáží se zničit ani dělit, a vypouští do okolí cytokiny – jakési poplašné zprávy. Z toho plynou mírné záněty, což je podhoubí pro spoustu nemocí.
Mitochondrie a covid-19
Mitochondrie jsou v hledáčku vědců zabývajících se výzkumem onemocnění covid-19. Vir Sars-CoV-2 si po průniku do buňky osedlá právě mitochondrie a manipuluje si s metabolickými dráhami podle svého. Pacienti s covid-19 mají narušenou funkci mitochondrií a deficit energie, což kompenzují přepnutím na glykolýzu. To s sebou nese další řetězec komplikací, což ovšem není námětem našeho článku, byť tento koronavirus významně ovlivňuje i jezdecký sport. Možná další výzkum v oblasti mitochondrií přinese nové možnosti.
O mitochondriích by se dal napsat celý seriál, jsou to opravdu úžasné součástky našich i koňských těl. Udržet je zdravé co nejdéle znamená mít koně vitálního i v relativně vysokém věku. Dalo by se to shrnout do třech P – pohyb, pastva (píce), psychika. Samozřejmě to nelze vytrhnout z celého kontextu managementu chovu, ale v základu to funguje. Na fotografii je 28letý teplokrevník Lusk – přiměřeně aktivní do 29 let, dožil se 32 let.

Zdroje:

Ostrov Naděje v Běstvinách u Dobrušky se ponoří do sváteční atmosféry. Už tuto sobotu 13. prosince od 1...

Pět, čtyři, tři… a kruciš! Jistě víte, že si parkuroví jezdci odpočítávají cvalové skoky před odskok...