Fyziologicky dochází u rostoucích zvířat k přestavbě chrupavky epifýzy a k její postupné osifikaci následkem vaskularizace a současné mineralizace a resorpce chondrocytů. Je to tedy poškození chrupavkových kanálů s následnou nekrózou v růstové chrupavce.
Dle lokalizace problému lze osteochondrózu dělit na tři typy:
Disekující osteochondróza (OCD) patří mezi vývojová onemocnění ortopedického aparátu koně. Může se vyskytovat od narození až do věku tří let, kdy se dle plemene dokončuje růst koně a uzavírají se růstové zóny. Kritickým obdobím je období ihned po narození hříběte, kdy toto onemocnění může postihnout hříbata řádně vyvinutá, ale i předčasně narozená.
Jde tedy o onemocnění, při kterém dochází k odumření části subchondrální kosti, následkem čehož vzniká defekt v kloubní chrupavce, ležící nad touto odumřelou kostí. Průběh onemocnění má několik stupňů, od počáteční nelokalizované léze, přes částečně až po úplně uvolněný fragment. V případě úplného uvolnění fragmentu vzniká nitrokloubní tělísko neboli „myška“.
Jasná příčina vzniku osteochondrózy zatím není známa. Velkou roli hraje množství faktorů, z nichž některé můžeme ovlivnit. Mezi nejvýznamnější patří výživa a genetika. Vliv může mít samozřejmě i pohybová aktivita jedince, jiná prodělaná onemocnění nebo úraz.
Příznaky osteochondrózy jsou variabilní od zcela neznatelných po permanentní kulhání. Osteochondróza dissecans, která se projevuje defekty na povrchu chrupavky, je charakterizována nekrózou a degenerací malých částí epifýzy. Následovat může abnormální reosifikace. Přesnou diagnózu lze určit na základě rentgenologického snímkování, nebo v některých případech až artroskopií. Klinicky se osteochondróza může, ale nemusí projevit. Mezi typické klinické příznaky patří kulhání, bolest při ohýbání kloubu a otoky v místě postiženého kloubu.
Terapie disekující osteochondrózy může být jak konzervativní, tak chirurgická. Také se využívá experimentální léčba. Konzervativní terapie se využívá v případech, kdy u pacienta není nutný chirurgický zákrok. V tomto případě jde o malé léze a fragmenty.
Tato terapie je založena zvláště na kvalitní stravě, využití podpůrných léčiv a managementu pohybu. Dále se používá léčba chirurgická, zejména u závažnějších případů. Tato terapie spočívá v odstranění defektu, například čipů, neboli volných tělísek, nebo odstranění odloučené chrupavky a očištění místa až na zdravou tkáň. Čím včasnější je odstranění léze nebo čipu, tím lepší je prognóza pro budoucí využití koně. V některých případech je možné fixovat odloučenou chrupavku na místo, kde se měla nacházet. Dále je pak možné vyčistit kostní cysty.
Jako další možná terapie se uvádí regenerační schopnost kmenových buněk. Kmenové buňky jsou základní stavební jednotkou mnohobuněčných organismů a vyznačují se dvěma základními funkcemi. Mohou tvořit další kmenové buňky a mají schopnost diferenciace ve specializované buňky, jako jsou neurony, myocyty, hepatocyty, krvinky, chondrocyty atd.
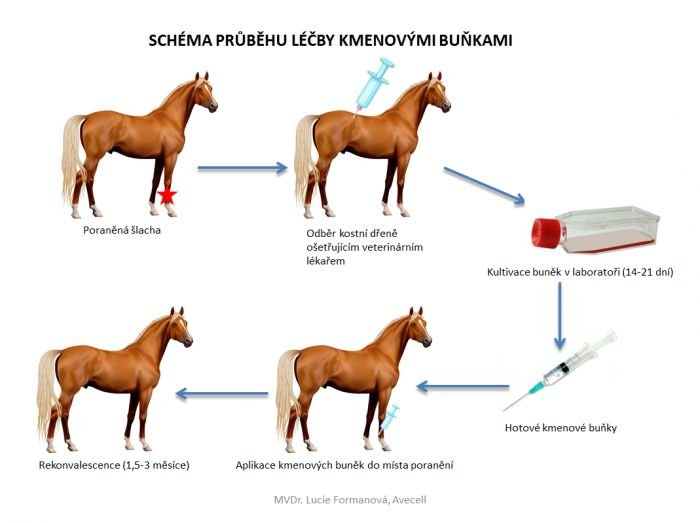
Dnešní experimentální ortopedie a traumatologie hledá další metody léčby defektů kloubní chrupavky vedoucí k úplné regeneraci původní tkáně se zachováním stejných funkčních vlastností, které měla tkáň před poraněním. Při současných možnostech odběru a manipulace s mezenchymálními kmenovými buňkami kostní dřeně (MSCs – Mesenchymal stem cells) je možné připravit autogenní nebo allogenní transplantát progenitorů hyalinní chrupavky. Navíc při neustále se prohlubující znalosti chondrogeneze je možné již in vitro poměrně přesně MSCs směrem k chondrocytům v diferenciaci nasměrovat. To vše je předpoklad pro primární hojení defektu kloubní plochy.
Díky funkcím mezenchymálních kmenových buněk, mezi které patří zvláště schopnost rozlišovat se na různé buněčné linie mezodermálních linií (včetně osteoblastů a chondrocytů) a parakrinní exprese několika růstových faktorů a cytokinů, které podporují opravu tkáně, došlo k zaměření jejich výzkumu v ortopedických regeneračních technikách. V rámci předklinických i klinických studií stále roste účinnost terapie MSC v léčbě osteochondritických defektů i u osteoartrózy.
Předklinické studie využívající techniky podobné metodám transplantace autologních chondrocytů, ale s rozdílem nahrazení chondrocytů za MSC, vykázaly pozitivní výsledky a zaznamenaly tvorbu hyalinní chrupavky v místě opravy.
Důležité je nedávné systematické přezkoumání a metaanalýzy předchozích klinických studií zkoumajících použití mezenchymálních kmenových buněk – intravaskulární a intraartikulární aplikace – a včetně autologních, alogenních a expandovaných přípravků MSC. Tyto studie naznačují, že terapie MSC je bezpečná. Žádné nežádoucí účinky včetně infekce, smrti a malignity nebyly zaznamenány.
Další výzkum je nutný k určení, zda výhody terapie mezenchymálními kmenovými buňkami jsou reprodukovatelné napříč větší populace a pro jiné degenerativní kloubní stavy včetně osteoartrózy.
Zdroje:

Ing. Petra Černá působí jako odborný asistent projektu Avecell. AVECELL® je veterinární projekt Medicínského centra Praha, v němž se tým odborníků zaměřuje na výzkum a využití nových metod léčby pomocí aplikace kmenových buněk ve veterinární medicíně.
Medicínské centrum Praha získalo povolení pro výrobu veterinárního léčivého přípravku (autologní mezenchymální kmenové buňky) od Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv (ÚSKVBL) v květnu 2015.

Zlaté pravidlo „krmit málo a často“ je mantrou každého výživáře. Pro koňský žaludek je to ideální p...

Ostrov Naděje v Běstvinách u Dobrušky se ponoří do sváteční atmosféry. Už tuto sobotu 13. prosince od 1...